血管钙化以动脉壁钙沉积和血管平滑肌细胞成骨软骨分化为特征,是一个受主动调控的复杂机制过程。血管钙化与心血管不良事件增加有关。4-羟基壬烯醛(4-HNE)是脂质过氧化最丰富的稳定产物,在血管钙化中的作用研究很少。
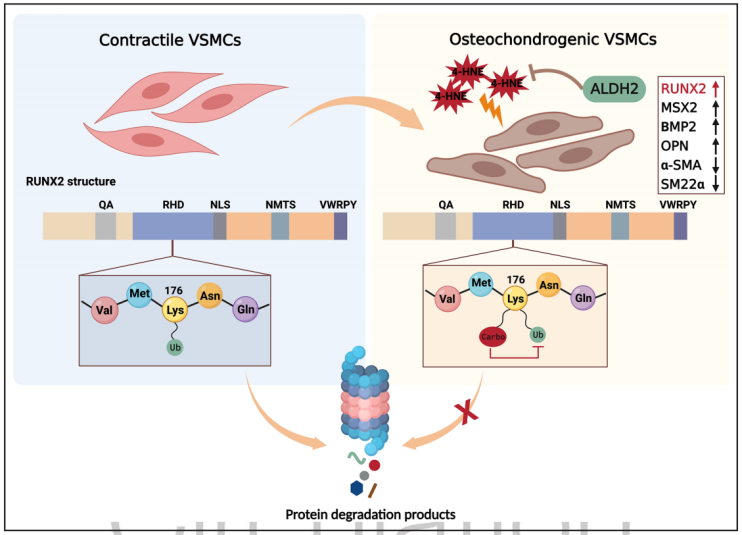
2024年2月13日,山东大学陈玉国、徐峰及Wei Shujian共同通讯在Circulation(IF 38)在线发表题为“Carbonylation of Runx2 at K176 by 4-Hydroxynonenal Accelerates Vascular Calcification”的研究论文,该研究发现4-羟基壬烯醛使Runx2在K176位点羰基化加速血管钙化。慢性肾脏病患者和模型小鼠血清中4-HNE水平升高,钙化动脉切片免疫染色检测4-HNE水平升高。ALDH2敲除或平滑肌细胞特异性ALDH2敲除加速了模型小鼠血管钙化的发展,而过表达或激活则阻止了小鼠血管钙化和血管平滑肌细胞的骨软骨分化。
在冠心病患者中,ALDH2 rs671基因突变的患者发生更严重的冠状动脉钙化。4-HNE促进小鼠主动脉平滑肌细胞和人主动脉平滑肌细胞的钙化和体外成骨软骨分化。4-HNE增加Runx2(矮子相关转录因子-2)水平,当Runx2被敲低时,4-HNE促进血管平滑肌细胞钙化的作用减弱。Runx2在赖氨酸176位点的突变降低了其羰基化,消除了4-HNE诱导的Runx2上调。该研究表明,4-HNE通过直接羰基化Runx2的K176位点来增加Runx2的稳定性,并促进血管钙化。ALDH2可能是治疗血管钙化的潜在靶点。

血管钙化是由钙在血管壁的异常沉积引起的,在动脉粥样硬化斑块的稳定和血管壁的狭窄中起着关键作用。异位血管钙化在慢性肾脏疾病(CKD)患者中广泛存在,主要发生在冠状动脉和主动脉瓣。尽管存在一些不一致之处,但血管钙化被认为是心血管事件的危险因素,增加了患者的发病率和死亡率。
几种类型的细胞,包括周细胞、血管平滑肌细胞(VSMCs)和肌成纤维细胞,参与血管钙化的过程VSMCs的骨软骨分化是血管钙化的主要因素,在血管钙化中起着关键作用Runx2 (runt相关转录因子-2)是VSMCs向骨软骨生成表型转变的中心调节因子。Runx2在动脉粥样硬化钙化血管组织标本中表达升高,Runx2的表达受成纤维细胞生长因子(FGF)信号和骨形态发生蛋白(BMP)信号的调控。此外,Runx2可以通过磷酸化、乙酰化和SUMOylation等方式进行翻译后修饰。
脂质过氧化产物已被证明在血管钙化过程中起重要作用在脂质过氧化过程中,产生各种醛类、酮类、酸类和其他低分子量挥发性物质。然而,迄今为止,脂质过氧化产物对血管钙化的影响很少被研究。4-羟基壬烯醛(4-HNE)是脂质过氧化的主要最终产物,是一种活性极强的有毒醛,可诱导蛋白质羰基化并与核酸发生反应。4-HNE在细胞增殖、细胞死亡和其他细胞过程中的作用已被充分研究,但4-HNE与血管钙化之间的关系尚不清楚。4-HNE的解毒作用主要由醛脱氢酶2 (ALDH2)介导ALDH2主要定位于线粒体,并通过清除4-HNE作为心肌损伤、中风、神经退行性疾病和癌症的保护因子。
模式图(Credit: Circulation)
该研究检测了人类标本和小鼠模型血管钙化过程中4-HNE的水平。体外研究4-HNE对VSMCs成骨软骨细胞分化的影响。利用基因工程小鼠,还探索了ALDH2在血管钙化中的可能作用。该研究发现4-HNE通过羰基化Runx2的K176位点而不改变其转录活性来稳定Runx2,从而加速血管钙化,促进VSMCs的骨软骨分化。总之,该研究揭示了4-HNE作为血管钙化的关键介质,并揭示了Runx2通过其K176位点的羰基化稳定的新机制。VSMCs中的ALDH2通过清除4-HNE阻止血管钙化。这些发现确定脂质过氧化和ALDH2是预防患者血管钙化的潜在靶点。
原文链接https://doi.org/10.1161/CIRCULATIONAHA.123.065830













